
Для исследований в российскую лабораторию из Перу были присланы образцы тканей мумий под именами «Мария» (Maria) и «Вавита» (Wawita). Предоставленные образцы биологических тканей были изучены с помощью сканирующей электронной микроскопии, Raman спектров, ICPE, исследован состав кизельгура (вещества на поверхности кожи мумий). Также проведёно исследование ДНК переданных тканей.
Подготовка образцов
Образцы ткани по 500 мкг переносили в пластиковые пробирки и растворяли в 1 мл буфера (10 мМ трис-НСI рН=10.5, 1 мМ ЭДТА, 0.15 М NаСI). К полученным суспензиям добавляли додецилсульфат Nа до 0.5% нагревали до +80 С и через 10 минут — протеиназу К (до 500 мкг/мл), помещали в термостат (+55 С) на 24 часа.
Депротеинизацию проводили фенольным способом: добавляя в равном объеме к суспензии фенол, затем фенол:хлороформ (1:1), хлороформ; после каждого добавления производили постоянное перемешивание на угловом роторе и центрифугирование при 15 тыс. об.мин., 10 мин.
К полученному после 3-го центрифугирования над-осадку прибавляли 1/10 часть от объема 1 М NaCI и 2,5 объема дважды перегнанного этилового спирта, и оставляли на ночь при -30 С в конических пробирках — «эппендорфах». Проводили центрифугирование при 15 тыс. об. мин. в течение 10 минут и получали ДНК «выпавшую» в виде осадка бурого цвета. Дважды промывали осадок ДНК 70% этиловым спиртом и сушили при комнатной температуре (1 ч) и затем растворяли в ТЕ буфере.
ПЦР проводили на программируемом термоциклере «My Cycler» («Bio=Rad»), используя стандартные олигопраймеры, синтезированные твердофазным методом на объединении «Beagler» (Санкт-Петербург). Реакционная смесь для амплификации объемом 25 мкл включала: 15 нМ каждого олигопраймера, 67 мМ трис-HCI рН=8.8 при +25 С, 16.6 мМ(NH4 ) SO4, 6.7 mM MgCI2 , 6.7 мкМ ЭДТА, 10 мМ 2 меркаптоэтанола, 170 мкг/мл БСА и смесь четырех основных dNTP в концентрации 1.0 мМ каждого и термостабильную ДНК-полимеразу Thermus thermophilis (5 ед/мкл) (НПО СибЭнзим). После денатурации (10 мин, 94 С) проводили по 35 циклов амплификации для каждой тест-системы: 94оC -1 мин, 58о С — 1 мин, 72о С — 1 мин. Для контроля специфичности в реакцию вводили образцы ДНК с известными генотипами по исследуемым локусам (маркерным системам), а также контрольные пробы, содержащие смесь реагентов без ДНК. После амплификации к аликвотам реакционной смеси (7мкл) добавляли буфер для окрашивания и разделяли вертикальным электрофорезом в 6%-ом полиакриламидном геле (210х150х1 мм), окрашивали этидиум бромидом и фотографировали под ультрафиолетовым светом. Для идентификации аллелей использовали соответствующие для данных локусов аллельные стандарты («лэддеры»).
Анализ ДНК
Для исследования была применена методика экзомного анализа ДНК человека на основе высокопроизводительного секвенирования с обогащением методом гибридизации.
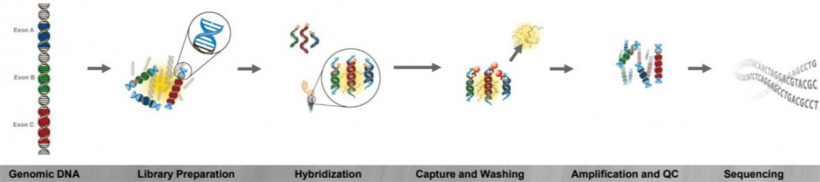
Было проанализировано 2 образца… Все этапы подготовки образца до ПЦР проводились в чистых помещениях. Подготовка образца, экстракция ДНК, амплификация отдельных фрагментов ДНК выполнялись в разных помещениях.
К концам геномной фрагментированной ДНК (~5 нг) были лигированы специфические адаптеры (KAPA Library Preparation Kit и SeqCap Adapter Kit; Roche), после чего был проведен двухэтапный отбор фрагментов в диапазоне длин 200-350bp с использованием магнитных частиц AMPureXP Beads (Beckman Coulter). Полученные фрагменты были амплифицированы с помощью праймеров, специфичных к адаптерам, и гибридизованы с биотинилированными специфическими зондами (NimbleGen SeqCap EZ Choice MedExome; Roche) в течение 28 ч при температуре 47°С. В одной реакции были объединены два ДНК-образца. Биотинилированные гибриды зондов-ДНК были выделены и очищены стрептовидиновыми конъюгированными магнитными частицами, проведена вторая амплификация и качественная оценка полученной ДНК-библиотеки (TapeStation 4200; Agilent Technologies). С целью удаления нецелевых фрагментов амплификации и димеров адаптеров ДНК-библиотека была повторно очищена с использованием магнитных частиц AMPureXP Beads (рис.1). Оценка конечной концентрации приготовленной библиотеки была проведена на приборе Quantus с использованием коммерческого набора QuantiFluor® dsDNA System (Promega). Полученная ДНК-библиотека была иммобилизирована на поверхность проточной ячейки. Секвенирование проводилось на платформе Illumina с использованием проточной ячейки Standard Flow Cell и реагентов MiSeq Reagent Kit v2 300 (2×150 cycles).
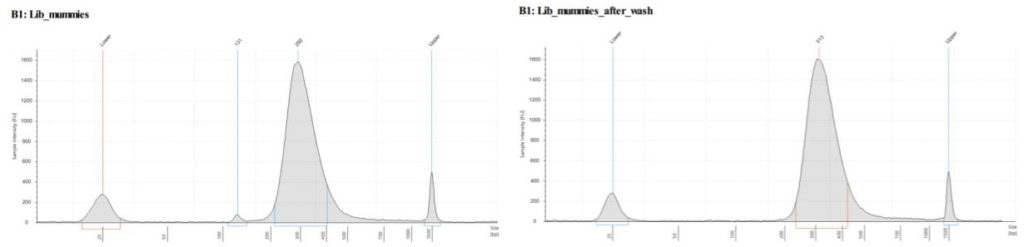
Общая оценка качества отсеквенированной ДНК
Для начальной оценки качества были использованы стандартные методы, такие как FastQC и оценка профиля кмеров программами Jellyfish and KraTER. Оценка качества не показало никаких проблем с качеством отсеквенированных ридов ДНК для обоих образцов. Картинки не приводятся так как не являются информативными.
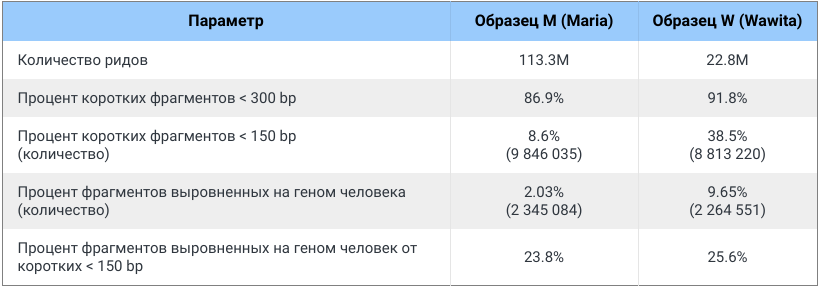
Для первого образца (дальше M, большая мумия «Мария») было отсеквенировано 113.4М ридов, для второго образца (дальше W, малая мумия «WaWita») было отсеквенировано 22.9М ридов.
Следующим шагом была очистка отсеквенированных ридов от различных технических последовательностей, которые будут мешать дальнейшему анализу. Для этого была использована программа Cookiecutter. После очистки осталось 113.3M (99%) ридов и 22.8M (99%) ридов соответственно для M и W.
Оценка количества древней ДНК и ее отделение от современной
Стандартным методом оценки наличия и количества древней ДНК является оценка количества поврежденных временем нуклеотидов. Для этого была использована программа MapDamage 2.0. MapDamage 2.0 что показало количество древней ДНК в 30.1%, но так как MapDamage подразумевает, что мы используем близкий референс, а мы точно не знаем насколько оба образца близки к геному современного человека, и мы использовали экзомную библиотеку, этот метод сам по себе не являлся достаточным. Другим хорошим методом оценки древней ДНК является количество коротких фрагментов.
Фильтрация предполагаемой древней ДНК происходила в три этапа. На первом этапе были убрана все парные риды, которые невозможно пересечь и собрать в один непарный рид с перехлестом. Такие риды говорили о том, что исходный фрагмент, который был секвенирован был длинней 300 п.н. и с большой вероятностью являлся современной ДНК. Так после этого шага осталось 86.9% и 91.8% соответственно. После этого одиночные фрагменты собранные с перехлестом были отобраны так, чтобы их длина была короче 150 п.н., так как именно такая длина ожидалась нами для древней ДНК. После этого шага осталось 8.6% и 38.5% соответственно для образцов M и W. Нужно обратить внимание, что несмотря на разницу в процентах, абсолютное количество ридов между образцами M и W очень схожее: 9.8M и 8.8M, что можно объяснить тем, что содержание именно древней ДНК в обоих образцах схожее.
Получение ДНК сходной с референсным геномом человека
Полученная предполагаемая древняя ДНК была картированы на референсный геном человека с помощью стандартного пайплайна поиска геномных вариантов с использованием BWA, samtools и Wcftools.
При этом только 23.8% от образца M и 25.6% было успешно замаплено на референсный геном современного человека. При этом для обоих образцов 75% отсеквенированных ридов не удалось замапить на геном человека. Что может быть объяснено как контаминациями так и тем, что эти образцы находятся достаточно далеко от генома современного человека. При это стоит держать в голове то, что мы секвенировали экзомную библиотеку и этим свели контаминацию бактериальной ДНК к минимуму.
Начальный разведывательной анализ незамапленных ридов показал, что часть из них принадлежит повторяющейся ДНК специфичной для копытных животных, это можно объяснить тем, что жир лам использовался при мумификации.
Для более подробного анализа требуется в районе трех недель вычислений, так как существующие решения сделаны только для вирусных и бактериальных геномов, а нам нужно сравнить с существующими всеми геномами, включая геномы растений, чтобы понять какие виды были отсеквенированы.
Характеристика найденных вариантов
Картированные риды были использованы для поиска вариантов отличающих M и W образцы от современного генома человека, а также для оценки контаминацией ридам c Y хромосомы человека.
Первый вопрос на который нужно было ответить, на какие именно хромосомы картировались отсеквенированные риды.
Так как мы знаем что образцы Марии выделалась из костей и мышц, а Вавиты только из костей, мы ожидали разницу в количестве мтДНК. Но особенной разницы не было.
Количество картированных ридов на Y – еще одна проверка на контаминацию современным человеком. Интересно, что оно оказалось одинаковым в обоих образцах.
Статистики по найденным вариантам приведены ниже:
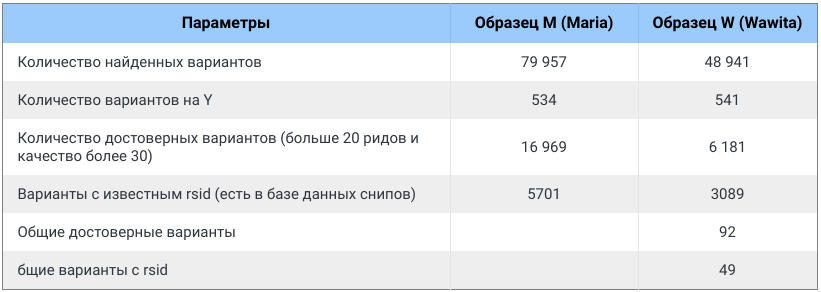
После этого стало возможным ответить на вопрос: родственники ли M и W? Ответ – нет.
Между M и W найдено только 49 совпадающих варианта и 3040 отличающихся для вариантов с известным rsid. Более того, возможно это разные виды или подвиды человека или неизвестного существа.
Интересно то, что варианты с Y хромосомы идентичны для обоих образцов, что говорит о контаминации одним и тем же человеком, и что в древней ДНК Y хромосомы скорей все же нет.
Оценка схожести с существующими отсеквенированными геномами человека из проекта 1000 геномов людей
Отметим, это только приблизительный анализ, так как для более точного анализа необходимы варианты из регионов генома находящихся под нейтральным отбором, а у нас экзомные данные.
Тем не менее с использованием 5708 вариантов для M или 3096 для S удалось провести вариант анализа по сравнению с данными 1000 геномов людей.
Результат PCA анализа на картинке внизу представляет из себя наложение двух картинок для M и W посчитанных по отдельности, так как общих вариантов между M и W слишком мало, чтобы оценить дистанции между M и W.

Как видно, нет совпадения ни с одной группой генов, также они отличаются друг от друга. Но нужно иметь в виду, что мы использовали кодирующие последовательности под отбором, а рекомендуется использовать варианты находящиеся под нейтральным отбором.
Тем не менее, результат PCA хорошо согласуется с ручной проверкой вариантов, показавшей, что данные находятся в нереференсной гомозиготе, что опять говорит о том, что образы находятся далеко от генома современного человека.
Заключение
К сожалению, мы были ограничены только двумя образцами, обычно в такого типа анализах используется больше, хотя бы 3-10 хоть как-то родственных. Поэтому необходимо продолжение исследований с большим количеством образцов.
В то же время можно с большой вероятностью заключить, что образцы ДНК Марии и Вавиты соответствуют человеческим ДНК, но не совпадают с доступными нам ДНК из базы данных 1000 человек.
Авторы доклада: Баранов В.С и Асеев М.В. (Научно-исследовательский институт акушерства и гинекологии, отдел пренатальной диагностики), Глотов А.С. и Глотов О.С. (СПб Государственный Университет), Комиссаров А.С. (Институт Цитологии АН РФ, Центр генетической биоинформатики).
Материалы предоставлены Константином Георгиевичем Коротковым (доктор технических наук, профессор, Университет Информационных Технологий, Механики и Оптики) и Дмитрием Владиславовичем Галецким (кандидат медицинских наук, Первый Санкт-Петербургский Государственный Медицинский Университет им. И.П. Павлова) специально для сайта «Мир тайн».
